Fuente: Nature Medicine
Un paso audaz hacia el xenotrasplante: Descifrando la respuesta inmunológica
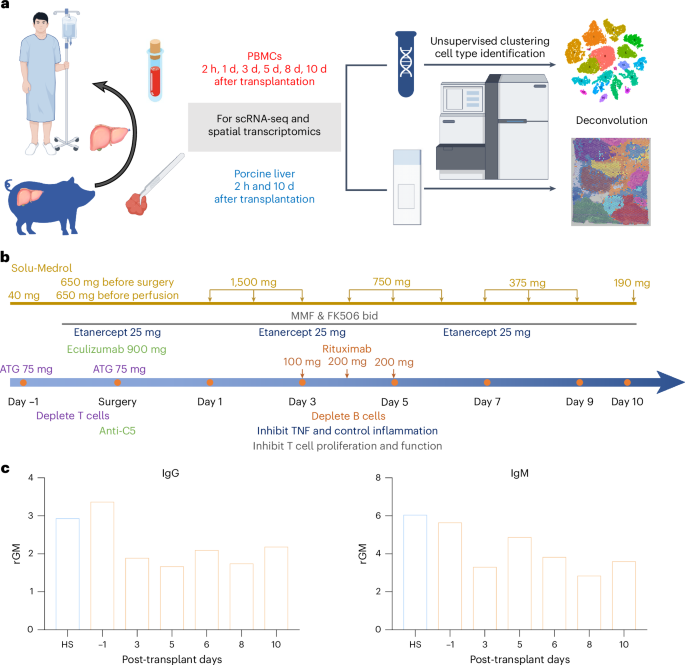
El xenotrasplante, o trasplante de órganos entre especies, representa una de las fronteras más prometedoras y desafiantes de la medicina moderna. En un estudio publicado en Nature Medicine, investigadores han explorado la dinámica inmunológica en un paciente humano fallecido que recibió un xenotrasplante de hígado de cerdo genéticamente modificado, monitoreado durante diez días. Este trabajo, que utiliza tecnologías avanzadas como la secuenciación de ARN unicelular y espacial, ofrece una visión detallada de cómo el sistema inmunológico humano responde a un órgano de otra especie, revelando tanto los obstáculos como las oportunidades de esta técnica revolucionaria. En un contexto donde la escasez de órganos para trasplantes sigue siendo una crisis global, este estudio plantea una pregunta fundamental: ¿cómo podemos controlar la respuesta inmunológica para hacer del xenotrasplante una solución viable?
La relevancia de esta investigación es innegable. Cada año, miles de pacientes mueren esperando un trasplante de órgano debido a la limitada disponibilidad de donantes humanos. Los cerdos, gracias a su similitud fisiológica con los humanos y los avances en edición genética, se han convertido en candidatos ideales para proporcionar órganos. Sin embargo, la barrera inmunológica sigue siendo un desafío crítico, ya que el cuerpo humano tiende a rechazar tejidos extraños. Este estudio no solo aporta datos cruciales sobre la interacción entre el sistema inmunológico humano y un hígado de cerdo, sino que también señala caminos para optimizar futuros xenotrasplantes, acercándonos a un futuro donde la escasez de órganos podría ser cosa del pasado.
Explorando el terreno inmunológico: Un enfoque innovador
Para investigar la respuesta inmunológica al xenotrasplante de hígado, los investigadores emplearon técnicas de vanguardia, incluyendo la secuenciación de ARN unicelular (scRNA-seq) y la secuenciación espacial de ARN, que permitieron analizar las poblaciones celulares en la sangre periférica y el hígado trasplantado con una precisión sin precedentes. Estas tecnologías revelaron un mapa detallado de las células inmunológicas involucradas, destacando cómo los linfocitos T, los monocitos y otros componentes celulares interactúan con el órgano xenogénico.
El paciente, monitoreado durante diez días tras recibir el hígado de un cerdo genéticamente modificado, proporcionó un caso único para estudiar las dinámicas inmunológicas en tiempo real. Los cerdos utilizados en este experimento fueron modificados para reducir la probabilidad de rechazo inmunológico, eliminando genes que desencadenan respuestas hiperagudas y expresando genes humanos para mejorar la compatibilidad. A pesar de estas modificaciones, el estudio encontró que el sistema inmunológico humano seguía reaccionando de manera compleja, con activación progresiva de linfocitos T en la sangre periférica y una infiltración significativa de células inmunológicas en el hígado trasplantado.
Un hallazgo clave fue la identificación de dos poblaciones distintas de monocitos que parecen desempeñar roles críticos en la respuesta al xenotrasplante. En las primeras fases tras el trasplante, los monocitos THBS1+ interactúan con plaquetas a través de la vía de señalización THBS1-CD36, lo que podría influir en la coagulación y prevenir complicaciones trombóticas. En una fase posterior, los monocitos C1QC+ se infiltraron en el hígado de cerdo, expresando niveles elevados de PD-L1, una molécula que induce agotamiento de los linfocitos T, debilitando la respuesta inmunológica adaptativa. Además, se observó una presencia significativa de linfocitos T gamma-delta (γδT) y linfocitos T agotados en el hígado trasplantado, lo que sugiere un entorno inmunosupresor que podría limitar la capacidad del cuerpo para combatir el rechazo.
Hallazgos que iluminan el camino y los obstáculos
Los resultados del estudio son tanto prometedores como reveladores de los desafíos pendientes. La activación progresiva de los linfocitos T en la sangre periférica indica que el sistema inmunológico humano reconoce el hígado de cerdo como extraño, iniciando una respuesta que podría conducir al rechazo si no se controla adecuadamente. Sin embargo, la infiltración de linfocitos T agotados y γδT en el hígado sugiere que el órgano xenogénico induce un estado de inmunosupresión local, posiblemente como un mecanismo de defensa contra el rechazo agudo. Este fenómeno podría ser aprovechado para desarrollar estrategias que prolonguen la supervivencia del injerto.
Los monocitos THBS1+ y C1QC+ representan un descubrimiento particularmente intrigante. La capacidad de los monocitos THBS1+ para regular la coagulación a través de interacciones con plaquetas es crucial, ya que los eventos trombóticos son una complicación común en el xenotrasplante. Por otro lado, los monocitos C1QC+, al expresar PD-L1, podrían contribuir a la inmunosupresión, pero también plantean el riesgo de debilitar la respuesta inmunológica general del paciente, aumentando la susceptibilidad a infecciones. Estos hallazgos destacan la necesidad de un equilibrio delicado entre prevenir el rechazo y mantener una inmunidad funcional.
El estudio también subraya la importancia de las modificaciones genéticas en los cerdos donantes. Aunque el hígado utilizado estaba diseñado para minimizar el rechazo, la respuesta inmunológica observada indica que aún se necesitan mejoras en la ingeniería genética para optimizar la compatibilidad. Por ejemplo, podrían desarrollarse cerdos con modificaciones adicionales para reducir la expresión de moléculas inmunogénicas o para modular la interacción con monocitos específicos.
Un nuevo paradigma en el xenotrasplante
El estudio abre la puerta a un nuevo paradigma en el xenotrasplante, donde la comprensión detallada de las respuestas inmunológicas puede guiar el desarrollo de estrategias más efectivas. La identificación de monocitos THBS1+ y C1QC+ como actores clave sugiere que las terapias dirigidas a estas poblaciones celulares podrían mejorar los resultados del xenotrasplante. Por ejemplo, medicamentos que modulen la vía THBS1-CD36 podrían prevenir complicaciones trombóticas, mientras que intervenciones que regulen la expresión de PD-L1 podrían equilibrar la inmunosupresión para evitar tanto el rechazo como la vulnerabilidad a infecciones.
Además, este trabajo plantea preguntas fundamentales sobre el futuro del xenotrasplante. ¿Cómo podemos optimizar las modificaciones genéticas en los cerdos para minimizar la respuesta inmunológica sin comprometer la funcionalidad del órgano? ¿Es posible desarrollar inmunosupresores específicos que actúen selectivamente sobre las células que median el rechazo, como los monocitos C1QC+? Estas preguntas no solo son relevantes para el xenotrasplante de hígado, sino también para otros órganos como el corazón y el riñón, que han sido objeto de estudios recientes.
Contexto y analogías: El xenotrasplante como un puente hacia el futuro
El xenotrasplante puede compararse con un puente que conecta la necesidad urgente de órganos con las limitaciones de la biología humana. Así como los puentes modernos requieren materiales avanzados y un diseño preciso para soportar cargas pesadas, el xenotrasplante depende de la ingeniería genética y la inmunología para superar las barreras biológicas. Este estudio actúa como un plano detallado, revelando las tensiones y los puntos de apoyo en este puente, desde la coagulación mediada por monocitos hasta la inmunosupresión inducida por PD-L1.
En el contexto más amplio, el xenotrasplante se enmarca en una carrera contra el tiempo para abordar la crisis de donación de órganos. Según la Organización Mundial de la Salud, millones de personas necesitan trasplantes cada año, pero la oferta de órganos humanos cubre solo una fracción de esta demanda. Los avances en la edición genética, como CRISPR-Cas9, han hecho posible modificar cerdos para que sus órganos sean más compatibles con los humanos, pero estudios como este demuestran que la biología del rechazo es más compleja de lo que se pensaba inicialmente.
Desafíos éticos y prácticos
El xenotrasplante no solo plantea retos científicos, sino también éticos. La idea de utilizar órganos de animales en humanos suscita preocupaciones sobre el bienestar animal, la seguridad a largo plazo y la aceptación social. Además, la implementación de esta tecnología en la práctica clínica requerirá marcos regulatorios robustos para garantizar que los procedimientos sean seguros y equitativos. La accesibilidad es otro desafío: aunque el xenotrasplante podría aliviar la escasez de órganos, su alto costo y la necesidad de infraestructura especializada podrían limitar su disponibilidad a países o poblaciones con recursos suficientes.
Hacia un futuro de trasplantes sin límites
El estudio publicado en Nature Medicine es un hito en el camino hacia el xenotrasplante como una solución viable para la crisis de órganos. Al mapear el paisaje inmunológico de un xenotrasplante de hígado, los investigadores han proporcionado una base sólida para futuras investigaciones, destacando el papel de los monocitos y los linfocitos T en la respuesta al injerto. Estos hallazgos no solo informan el desarrollo de nuevas terapias inmunosupresoras, sino que también subrayan la importancia de la ingeniería genética para mejorar la compatibilidad de los órganos de cerdo.
A medida que avanzamos, el xenotrasplante podría transformar la medicina de trasplantes, ofreciendo esperanza a millones de pacientes en lista de espera. Sin embargo, este futuro dependerá de nuestra capacidad para abordar los desafíos inmunológicos, éticos y logísticos con la misma precisión y creatividad que han caracterizado este estudio. En última instancia, el xenotrasplante no es solo una hazaña científica, sino un testimonio del potencial humano para superar las limitaciones biológicas y construir un mundo donde la salud no esté limitada por la disponibilidad de órganos.
Un paso audaz hacia el xenotrasplante: Descifrando la respuesta inmunológica
El xenotrasplante, o trasplante de órganos entre especies, representa una de las fronteras más prometedoras y desafiantes de la medicina moderna. En un estudio publicado en Nature Medicine, investigadores han explorado la dinámica inmunológica en un paciente humano fallecido que recibió un xenotrasplante de hígado de cerdo genéticamente modificado, monitoreado durante diez días. Este trabajo, que utiliza tecnologías avanzadas como la secuenciación de ARN unicelular y espacial, ofrece una visión detallada de cómo el sistema inmunológico humano responde a un órgano de otra especie, revelando tanto los obstáculos como las oportunidades de esta técnica revolucionaria. En un contexto donde la escasez de órganos para trasplantes sigue siendo una crisis global, este estudio plantea una pregunta fundamental: ¿cómo podemos controlar la respuesta inmunológica para hacer del xenotrasplante una solución viable?
La relevancia de esta investigación es innegable. Cada año, miles de pacientes mueren esperando un trasplante de órgano debido a la limitada disponibilidad de donantes humanos. Los cerdos, gracias a su similitud fisiológica con los humanos y los avances en edición genética, se han convertido en candidatos ideales para proporcionar órganos. Sin embargo, la barrera inmunológica sigue siendo un desafío crítico, ya que el cuerpo humano tiende a rechazar tejidos extraños. Este estudio no solo aporta datos cruciales sobre la interacción entre el sistema inmunológico humano y un hígado de cerdo, sino que también señala caminos para optimizar futuros xenotrasplantes, acercándonos a un futuro donde la escasez de órganos podría ser cosa del pasado.
Explorando el terreno inmunológico: Un enfoque innovador
Para investigar la respuesta inmunológica al xenotrasplante de hígado, los investigadores emplearon técnicas de vanguardia, incluyendo la secuenciación de ARN unicelular (scRNA-seq) y la secuenciación espacial de ARN, que permitieron analizar las poblaciones celulares en la sangre periférica y el hígado trasplantado con una precisión sin precedentes. Estas tecnologías revelaron un mapa detallado de las células inmunológicas involucradas, destacando cómo los linfocitos T, los monocitos y otros componentes celulares interactúan con el órgano xenogénico.
El paciente, monitoreado durante diez días tras recibir el hígado de un cerdo genéticamente modificado, proporcionó un caso único para estudiar las dinámicas inmunológicas en tiempo real. Los cerdos utilizados en este experimento fueron modificados para reducir la probabilidad de rechazo inmunológico, eliminando genes que desencadenan respuestas hiperagudas y expresando genes humanos para mejorar la compatibilidad. A pesar de estas modificaciones, el estudio encontró que el sistema inmunológico humano seguía reaccionando de manera compleja, con activación progresiva de linfocitos T en la sangre periférica y una infiltración significativa de células inmunológicas en el hígado trasplantado.
Un hallazgo clave fue la identificación de dos poblaciones distintas de monocitos que parecen desempeñar roles críticos en la respuesta al xenotrasplante. En las primeras fases tras el trasplante, los monocitos THBS1+ interactúan con plaquetas a través de la vía de señalización THBS1-CD36, lo que podría influir en la coagulación y prevenir complicaciones trombóticas. En una fase posterior, los monocitos C1QC+ se infiltraron en el hígado de cerdo, expresando niveles elevados de PD-L1, una molécula que induce agotamiento de los linfocitos T, debilitando la respuesta inmunológica adaptativa. Además, se observó una presencia significativa de linfocitos T gamma-delta (γδT) y linfocitos T agotados en el hígado trasplantado, lo que sugiere un entorno inmunosupresor que podría limitar la capacidad del cuerpo para combatir el rechazo.
Hallazgos que iluminan el camino y los obstáculos
Los resultados del estudio son tanto prometedores como reveladores de los desafíos pendientes. La activación progresiva de los linfocitos T en la sangre periférica indica que el sistema inmunológico humano reconoce el hígado de cerdo como extraño, iniciando una respuesta que podría conducir al rechazo si no se controla adecuadamente. Sin embargo, la infiltración de linfocitos T agotados y γδT en el hígado sugiere que el órgano xenogénico induce un estado de inmunosupresión local, posiblemente como un mecanismo de defensa contra el rechazo agudo. Este fenómeno podría ser aprovechado para desarrollar estrategias que prolonguen la supervivencia del injerto.
Los monocitos THBS1+ y C1QC+ representan un descubrimiento particularmente intrigante. La capacidad de los monocitos THBS1+ para regular la coagulación a través de interacciones con plaquetas es crucial, ya que los eventos trombóticos son una complicación común en el xenotrasplante. Por otro lado, los monocitos C1QC+, al expresar PD-L1, podrían contribuir a la inmunosupresión, pero también plantean el riesgo de debilitar la respuesta inmunológica general del paciente, aumentando la susceptibilidad a infecciones. Estos hallazgos destacan la necesidad de un equilibrio delicado entre prevenir el rechazo y mantener una inmunidad funcional.
El estudio también subraya la importancia de las modificaciones genéticas en los cerdos donantes. Aunque el hígado utilizado estaba diseñado para minimizar el rechazo, la respuesta inmunológica observada indica que aún se necesitan mejoras en la ingeniería genética para optimizar la compatibilidad. Por ejemplo, podrían desarrollarse cerdos con modificaciones adicionales para reducir la expresión de moléculas inmunogénicas o para modular la interacción con monocitos específicos.
Un nuevo paradigma en el xenotrasplante
El estudio abre la puerta a un nuevo paradigma en el xenotrasplante, donde la comprensión detallada de las respuestas inmunológicas puede guiar el desarrollo de estrategias más efectivas. La identificación de monocitos THBS1+ y C1QC+ como actores clave sugiere que las terapias dirigidas a estas poblaciones celulares podrían mejorar los resultados del xenotrasplante. Por ejemplo, medicamentos que modulen la vía THBS1-CD36 podrían prevenir complicaciones trombóticas, mientras que intervenciones que regulen la expresión de PD-L1 podrían equilibrar la inmunosupresión para evitar tanto el rechazo como la vulnerabilidad a infecciones.
Además, este trabajo plantea preguntas fundamentales sobre el futuro del xenotrasplante. ¿Cómo podemos optimizar las modificaciones genéticas en los cerdos para minimizar la respuesta inmunológica sin comprometer la funcionalidad del órgano? ¿Es posible desarrollar inmunosupresores específicos que actúen selectivamente sobre las células que median el rechazo, como los monocitos C1QC+? Estas preguntas no solo son relevantes para el xenotrasplante de hígado, sino también para otros órganos como el corazón y el riñón, que han sido objeto de estudios recientes.
Contexto y analogías: El xenotrasplante como un puente hacia el futuro
El xenotrasplante puede compararse con un puente que conecta la necesidad urgente de órganos con las limitaciones de la biología humana. Así como los puentes modernos requieren materiales avanzados y un diseño preciso para soportar cargas pesadas, el xenotrasplante depende de la ingeniería genética y la inmunología para superar las barreras biológicas. Este estudio actúa como un plano detallado, revelando las tensiones y los puntos de apoyo en este puente, desde la coagulación mediada por monocitos hasta la inmunosupresión inducida por PD-L1.
En el contexto más amplio, el xenotrasplante se enmarca en una carrera contra el tiempo para abordar la crisis de donación de órganos. Según la Organización Mundial de la Salud, millones de personas necesitan trasplantes cada año, pero la oferta de órganos humanos cubre solo una fracción de esta demanda. Los avances en la edición genética, como CRISPR-Cas9, han hecho posible modificar cerdos para que sus órganos sean más compatibles con los humanos, pero estudios como este demuestran que la biología del rechazo es más compleja de lo que se pensaba inicialmente.
Desafíos éticos y prácticos
El xenotrasplante no solo plantea retos científicos, sino también éticos. La idea de utilizar órganos de animales en humanos suscita preocupaciones sobre el bienestar animal, la seguridad a largo plazo y la aceptación social. Además, la implementación de esta tecnología en la práctica clínica requerirá marcos regulatorios robustos para garantizar que los procedimientos sean seguros y equitativos. La accesibilidad es otro desafío: aunque el xenotrasplante podría aliviar la escasez de órganos, su alto costo y la necesidad de infraestructura especializada podrían limitar su disponibilidad a países o poblaciones con recursos suficientes.
Hacia un futuro de trasplantes sin límites
El estudio publicado en Nature Medicine es un hito en el camino hacia el xenotrasplante como una solución viable para la crisis de órganos. Al mapear el paisaje inmunológico de un xenotrasplante de hígado, los investigadores han proporcionado una base sólida para futuras investigaciones, destacando el papel de los monocitos y los linfocitos T en la respuesta al injerto. Estos hallazgos no solo informan el desarrollo de nuevas terapias inmunosupresoras, sino que también subrayan la importancia de la ingeniería genética para mejorar la compatibilidad de los órganos de cerdo.
A medida que avanzamos, el xenotrasplante podría transformar la medicina de trasplantes, ofreciendo esperanza a millones de pacientes en lista de espera. Sin embargo, este futuro dependerá de nuestra capacidad para abordar los desafíos inmunológicos, éticos y logísticos con la misma precisión y creatividad que han caracterizado este estudio. En última instancia, el xenotrasplante no es solo una hazaña científica, sino un testimonio del potencial humano para superar las limitaciones biológicas y construir un mundo donde la salud no esté limitada por la disponibilidad de órganos.
Enlace a la fuente original: